 |
 |
|
 |
| Le protocole de collecte |
|
 |
| Au préalable |
|
 |
Il est nécessaire de connaître l’endroit où l’on pense collecter. Ne jamais pénétrer sur un espace privé sans y être invité. Présentez-vous aux propriétaires ou aux autorités, expliquez les buts de votre démarche. Respecter les milieux sur lesquels vous évoluez, dans un esprit naturaliste, en ne prélevant que ce qui est nécessaire à votre étude, en préservant la faune et la flore environnante, les frayères des poissons,… « Science sans conscience n’est que ruine de l’âme »… Les prélèvements peuvent être renouvelés aux mêmes stations à intervalles réguliers, ce qui permet de noter un possible remplacement d’espèces sur un même site au fil des saisons. Cette démarche permet aussi, en cas de pollution, d'estimer, au travers des modifications éventuelles dans la structure des communautés d'insectes aquatiques, une dégradation ou une amélioration du milieu étudié. Que vous identifiiez vous-même les animaux récoltés ou que vous les confiiez à la coordination nationale de chaque inventaire, le protocole de travail est très simple. Deux cas se présentent : capture de larves et/ou capture d'adultes.
 |
| ************** |
|
 |
|
 |
| Méthodes de prélèvement des larves |
|
 |
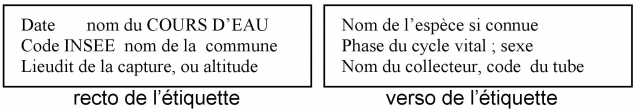
Essayer, autant que possible, de ne collecter que des spécimens âgés, proches de l'émergence (les larves jeunes sont plus délicates à déterminer). Il est possible d'utiliser indistinctement des filets à maille très fine, des passoires à riz métalliques, également à tamis très fin, ainsi que le prélèvement à la pince souple pour les espèces qui vivent sur des pierres. Il faut prospecter TOUS les micro-habitats (=micro-milieux) disponibles (pierres, chevelu racinaire, bois mort, végétaux aquatiques, sous-berges, tamisage du gravier ou du sable, etc.) avec la plus grande variété possible de vitesses de courant. Après prélèvement, les insectes sont placés (avec les plus grandes précautions, en raison de la fragilité de divers appendices - notamment branchies - indispensables à la détermination) dans un tube ou un pilulier contenant de l'alcool éthylique à 90%. Une petite étiquette sera glissée dans chaque tube de collecte sur le terrain, mentionnant au crayon gras (2B), le lieu, la date, le nom du collecteur, et le code du tube ainsi constitué. Le code doit être strictement identique à celui mentionné sur la fiche de prélèvement. Les caractéristiques de la station sont consignées, immédiatement, sur un carnet ad hoc, afin de compléter la fiche de prélèvement le plus précisément possible.
 |
| ************** |
|
 |
|
 |
| Méthodes de prélèvement des adultes |
|
 |
Ils seront capturés soit au filet à papillon classique (remplacer la mousseline par du tulle, plus rigide, et risquant moins de détériorer les captures), soit attirés, de nuit, avec un piège lumineux (les Trichoptères viennent généralement bien au piège lumineux). Le « parapluie japonais » est très efficace lorsqu'on prospecte des ruisseaux ou des rivières à ripisylve assez développée. De même, pour les Plécoptères, la chasse à vue avec juste ses yeux et une pince souple d'entomologiste est une méthode très intéressante, qui peut être complémentaire du parapluie. On se concentre en général sur les gros blocs rocheux émergés et les mousses qui les recouvrent, les troncs d'arbres, berges, macrophytes, ainsi que les piles des ponts et les parapets. Méthode également intéressante pour récolter les exuvies nymphales. Dans le cas de la capture de subimagos (les "duns" des anglo-saxons) chez les Ephémères, il est préférable de les conserver vivantes SANS TOUCHER LES AILES, dans un pilulier (un gobelet en plastique transparent est idéal) recouvert de tulle ou de gaze, jusqu'à la transformation (quelques heures à quelques jours) en imago. En effet, certains caractères spécifiques sont difficilement discernables sur les subimagos. Là également, comme pour les larves, les plus grandes précautions de manipulation s'imposent, compte tenu de la fragilité de ces insectes. Les imagos seront conservées en alcool éthylique à 70% et les mêmes règles d'étiquetage seront rigoureusement suivies.
 |
| ************** |
|
 |
|
 |
| Conditionnement des échantillons |
|
 |
Que ce soit pour les larves ou les adultes, éviter de conserver des bulles d'air dans le tube car celles-ci agissent, pendant le transport, comme de véritables "petits cailloux" qui détériorent les animaux. On pourra placer une petite bourre de coton, sous le bouchon, sans laisser d'air entre l'alcool contenant les spécimens et la bourre. On prendra garde également de ne pas accumuler trop de larves dans un même tube, ce qui a pour effet de faire chuter la concentration en alcool du liquide conservateur, donc de rendre celui-ci impropre à l’usage demandé.
Un petit matériel de départ est nécessaire: loupes, pinces fines et souples, flacons à prélèvement du type de ceux utilisés par les laboratoires d'analyse humaine -tubes à prélèvement d'urines en plastique- à se procurer en pharmacie, passoires à riz métalliques à TAMIS FIN, alcool à 70%. (nous pouvons fournir quelques tubes plastique, régulièrement remplacés à chaque transmission d'échantillons) Un ouvrage (à notre sens indispensable) propose des dessins clairs, des clés de détermination au genre lisibles de courts textes explicatifs. Il s'agit de : Tachet, H, P. Richoux, M. Bournaud & P. Usseglio-Polatera. 2010. Invertébrés d’eau douce, systématique, biologie, écologie. CNRS éditions, Paris : 607 pp.
 |
| ************** |
|
 |
|
 |
| La fiche de prélèvement |
|
 |
Vous pouvez télécharger la fiche de prélèvement à la fin de ce paragraphe. Dans le cadre d'études sur un seul groupe, il existe des fiches de prélèvements spécifiques que vous pouvez trouver dans sur les pages des différents groupe (Ephémères).
Elle est volontairement cantonnée à la partie recto d’une page A4. Cependant, notre méconnaissance des trois groupes étudiés fait qu’un apport d’informations sur les milieux colonisés, le plus précis possible est déterminant pour la vocation «patrimoniale» et «indicatrice» que nous voulons donner à notre trilogie d’inventaires. Le verso de la fiche est donc réservé à d’éventuelles remarques complémentaires facultatives. Les rubriques proposées sont indicatives. Seules celles relatives à l’identification du collecteur, du ou des tube(s) joint(s), de la station et de la date sont rigoureusement obligatoires.
Notice pratique d'utilisation de la fiche
Cadre "collecte" - NOM DU COLLECTEUR : pas de problème particulier, ajouter le prénom si nécessaire.
- CODE : c’est celui que vous donne la coordination nationale et qui vous est propre (à connaître et conserver, certaines pages sur le site Internet ne seront disponibles, à terme, qu’aux possesseurs de ce code, avec vérification sur le nom).
- CODAGE DES PILULIERS : Le numéro de tube vous est propre (en utilisant soit des lettres soit des chiffres) l'essentiel étant que ce codage personnel soit rigoureusement identique à celui noté sur l'étiquette que vous avez glissée dans le tube. Vous pourriez utiliser aussi les 4 chiffres de votre code collecteur, suivis des 4 chiffres correspondant au numéro d’ordre de votre tube. Exemples 31010001, 31010002, pour le collecteur 3101. Plusieurs tubes peuvent correspondre à une même fiche, puisque de nombreux taxons peuvent être présents dans les milieux prospectés (un pré-tri par Ordres, éventuellement par familles au sein de cet Ordre, etc., est envisageable et conseillé).
- DATE DU PRELEVEMENT : ne pas l’oublier, elle est indispensable à la validation de la donnée.
- LOCALITE ET CODES : c’est la commune de prélèvement, précisée par son code postal ou mieux son code INSEE si on le connaît, ce dernier ne variant pas ce qui n'est pas le cas pour le premier.
- LOCALISATION PRECISE : il s'agit de la mention du lieudit. Exemple: "Pré du Père François", "La Forge", "Pont des Soupirs", ou plus simplement pont CD72, etc., généralement indiqué sur la carte IGN 1/25000. On joindra une copie de cette carte avec mention en rouge du lieu prospecté.
- LATITUDE, LONGITUDE : l’idéal est de disposer d’un GPS (NORD VRAI !) mais on peut aussi la retrouver, grossièrement, avec les cartes IGN ou sur des sites internet comme le géoportail. Cette mention sera indispensable ultérieurement pour les cartes détaillées (non diffusées) qui seront établies.
- ALTITUDE : noter l' altitude en mètres.
Cadre "station" - RIVIERE, ETANG : nom du cours d’eau prospecté, ou de la pièce d’eau (lac, étang, mare,...) si milieu stagnant.
- BASSIN VERSANT : c’est celui de la rivière principale concernée.
- SOUS-BASSIN : exemple la Marne pour le Bassin de la Seine.
- ORDRE (classification de Strahler) : tous les cours d’eau en amont de leur première confluence sont considérés comme d’ordre 1, à la condition que le débit soit > à 32 L/s (cela représente en gros un ru de 1 m de large, 10 cm de profondeur moyenne, avec une vitesse de l'eau de 30 cm/s). Deux rivières d’ordre 1 donnent une rivière d’ordre 2, deux rivières d’ordre 2 donnent une rivière d’ordre 3, etc. Cette classification a l’avantage d’être internationalement pratiquée, et de permettre la comparaison entre des macrofaunes sur des régions différentes.
- LARGEUR : lit du mouillé en mètres
- PROFONDEUR MOYENNE : en mètres
- LONGUEUR DE LA ZONE PROSPECTEE : grossièrement, pour évaluer la taille de la station. Rappelons ici que le protocole de l’IBGN définit une station comme une longueur égale à 15 fois la largeur du lit mouillé.
- LARGEUR RIPISYLVE : sur la Rive gauche et la Rive droite, très important dans le cas de « rivières-galeries », comme il en subsiste encore quelques unes en Bretagne par exemple. Une ripisylve nulle est un élément généralement défavorable à la biodiversité spécifique du macrobenthos, mais une rivière totalement ombragée également.
Cadre "environnement"
- NATURE DU SUBSTRAT : entourer le type de substrat observé selon le code suivant :
- GR1: vases, argiles (<0,1mm)
- GR2: sables (0,1 à 2mm)
- GR3: graviers
- GR4: galets, cailloux
- GR5: grosses pierres (<250mm)
- VG1: algues, bactéries, champignons
- VG2: spermaphytes (herbiers)
- VG3: bryophytes (mousses)
- VG4: éléments végétaux grossiers: litière, racines, branchages immergés
- TEMPERATURES : pas de problème. (donnée complémentaire mais non obligatoire)
- pH : seulement au pHmètre (attention à l'étalonnage). (donnée complémentaire mais non obligatoire)
- ECLAIREMENT : exprimé en x/8 ; nécessaire pour distinguer les rivières de sous-bois, dont les faunes sont variables en fonction du couvert végétal.
Cadre "détermination collectes" - CODE DES ESPECES DETERMINEES : Chacun peut pré-déterminer ses taxons (dans ce cas, il est préférable de les isoler chacun dans un tube). Le code, établi et conservé pour chaque espèce par la coordination nationale des inventaires, est donné sur une liste pour chacun des trois ordres d'insectes. Exemple : 0310 pour l'Ephéméroptère Baetis nicolae. Les listes pour Plécoptères et Trichoptères seront très prochainement données (voir le site opie-benthos) ; On notera par exemple L 0310 pour signifier que l'on a capturé une larve (L) de Baetis nicolae. Ou encore I♀ 0501 pour une imago femelle de Cloeon dipterum ou s♂1101 pour une subimago mâle de Siphlonurus aestivalis.
- DETERMINATEUR 1 : c'est le nom (ou mieux son code) de la personne qui a déterminé la ou les espèces mentionnées plus haut. Vous pouvez l'indiquer si vous déterminez vous-même vos exemplaires. Cette mention est facultative et réservée à la coordination nationale de chaque inventaire dans le cas d'une détermination effectuée par une personne différente du collecteur.
- DETERMINATEUR 2 : c'est le nom, ou le code, de la personne qui vérifie cette première détermination au moment de la mise en collection centrale. En cas de désaccord, des communications entre les deux déterminateurs sont engagées et un appel à un spécialiste pour le groupe d'insectes concerné est effectué.
Verso de la feuille (mentions facultatives) Les parties « environnement » et « micro-milieux » ne nous semblent pas devoir être commentées longuement. Simplement, ne pas oublier que l’environnement de la station doit être mentionné en pourcentage (de 10% en 10 %). Un prélèvement en plein village sera à 100% « village ou bourg », un prélèvement le long d’un lotissement en rive droite, et d’une forêt en rive gauche sera indiqué 50 % pour chacun. Les micro-milieux (= micro-habitats) prospectés supposent que l’on indique le(s) numéro(s) de tube(s) concerné(s) dans la rubrique ad hoc. Exemple 75010001 sur vase et limon, 7501002 et 75010003 sur litière feuilles mortes, 75010004 sur macrophytes immergés, etc. Les parties atteintes anthropiques (pollutions et modifications hydrologiques) sont à renseigner. Si nécessité, le verso de la page autorise la rédaction de quelques lignes, un plan succinct, etc. Indiquer dans le cadre ad hoc, situé en dessous, si des micro-habitats doivent encore être échantillonnés. C’est un outil qui doit servir au collecteur pour des prélèvements futurs. |
 |
|
 |
| Comment et où adresser les échantillons ? |
|
 |
Avec le ou les piluliers, vous devez joindre la fiche de prélèvement renseignée, une copie de la carte ou de la zone de cette carte concernée par la station prospectée. Pour ce qui concerne le conditionnement, les tubes ou les piluliers doivent être rendus hermétiques pendant le transport ou l'acheminement (adhésif autour du bouchon par exemple) et bien isolés des chocs (papier à bulle, enveloppe matelassée, carton renforcé...). Bien penser à mettre l'étiquette à l'intérieur du tube ou du pilulier. Par ailleurs, des analyses physico-chimiques sont parfois disponibles (DREAL, ONEMA, DDASS, Agence de l'eau). Si nécessaire (cas de pollutions visibles), ne pas hésiter à se les procurer et en joindre une copie. En l’état actuel, l’envoi doit s’effectuer, à l’adresse suivante : Opie-benthos, coordinationRoute de la Minière B.P. 30 78041 GUYANCOURT CEDEX Pour tout renseignement, s’adresser à : mb2@invfmr.org
 |
| ************** |
|
 |
|
 |
| Informations supplémentaires |
|
 |
Elevage Il est possible, et fortement conseillé notamment dans le cas de travaux visant à mieux préciser le statut taxinomique de certaines espèces, de conserver les larves capturées dans un petit bac reconstituant les conditions du milieu (eau, substrat, température, vitesse du courant, oxygénation...). Mieux, des aménagements du bac (fond, décor naturel) peuvent être mis en place pour des prises de vue (récolte de nourriture des larves, émergence et imagination des Ephémères,...).
Cette technique permet de lier directement la larve (conserver soigneusement l'exuvie larvaire ou nymphale selon le groupe d'insectes) à l'adulte.
Des précisions sur les techniques peuvent être données (publications scientifiques, site www. opie-benthos.fr, revue Ephemera, bulletin de liaison Opie-benthos,...).
 |
| ************** |
|
 |
|
 |
| Résultats |
|
 |
| Prolongement : détermination des espèces |
|
 |
Si vous souhaitez vous initier à l’identification des espèces d’éphémères, l’OPIE-benthos peut vous aider : - recherche de documentation,
- conseils,
- séances d’information,
- conférences,
- stages,
- …
Cependant, des moyens optiques sont nécessaires : - loupe binoculaire permettant généralement un grossissement de l'ordre de X20 à X80 pour répondre aux exigences des clés de détermination,
- microscope pour l'observation de structures plus fines : pièces buccales, soies des pattes, épines...
De petits matériels sont indispensables pour la manipulation des échantillons, les dissections : - pinces fines,
- minuties
- aiguilles emmanchées sur des mandrins ou fixées à la cyanolite sur des supports,
- …
On pourra efficacement se reporter à la petite brochure de microscopie pratique directement consultable par commande auprès de la coordination Opie-benthos (tarif et commande : mb2@invfmr.org). On trouvera dans le chapitre documentation de chaque ordre, une liste d’ouvrages utiles.
 |
| ************** |
|
 |
|
 |
|
 |
|
 |



